鋰離子電池在長期的存儲過程中會面臨著自放電過大的風險,特別是在較低的開路電壓下,由於自放電過大可能導致鋰離子電池的電壓過低,引起負極負極的銅箔溶解等風險,由於溶解的銅元素在充電的過程中會再次在負極表面析出,產生的金屬銅枝晶可能會刺穿隔膜,引起正負極短路,因此發生過度放電或者電壓過低都會導致鋰離子電池徹底失效。
目前對於過放電過程中鋰離子電池內部發生的反應我們還不是特別清楚,為了了解這一反應過程,德國明斯特大學的Johannes Kasnatscheew等人利用三電極體係對過放電過程中鋰離子電池正負極電壓的變化進行了詳細的研究。
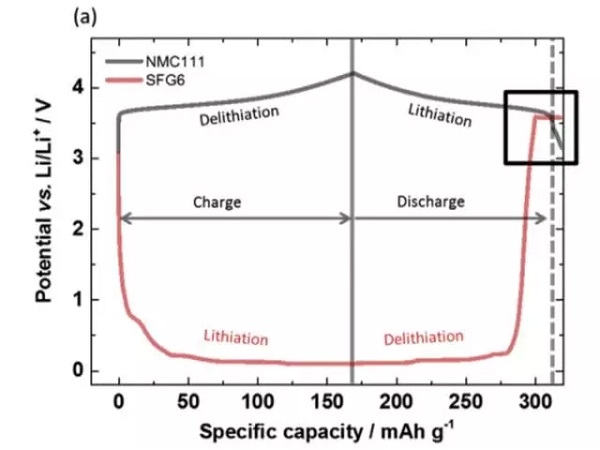
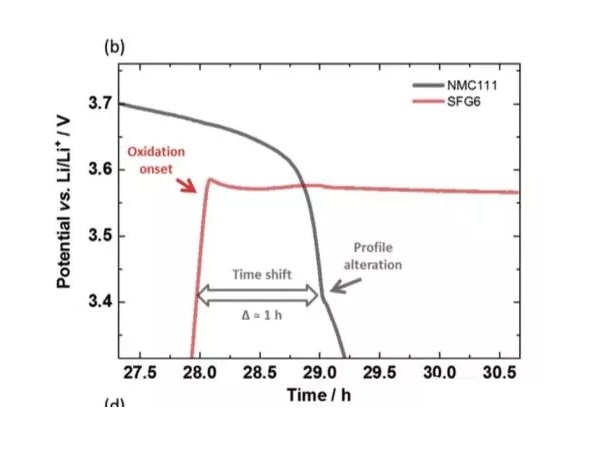
實驗中Johannes Kasnatscheew等採用的電池為NMC111/石墨體系,金屬鋰作為參比電極。從下圖a中可以看到,在充電的過程中隨著Li+從正極的脫出,正極的電勢緩慢升高,負極電勢在快速下降到1V一下,在放電的過程中正好相反,Li+從負極脫出回到正極,正極電勢逐下降,當負極完全脫鋰後,電勢迅速升高,並在3.56V左右出現了一個電壓平台,下圖b為該區域的放大圖,從正負極電壓曲線上可以看到,正極電壓曲線的變化相對於負極有大約1h的延遲,隨後正極的電勢也開始快速下降,正極電勢低於負極石墨的電勢。該電壓曲線變化非常符合銅箔溶解的特點,銅箔中的銅元素首先被氧化為Cu1+,Cu1+遷移到正極表面並在正極表面還原,沉積為金屬銅。
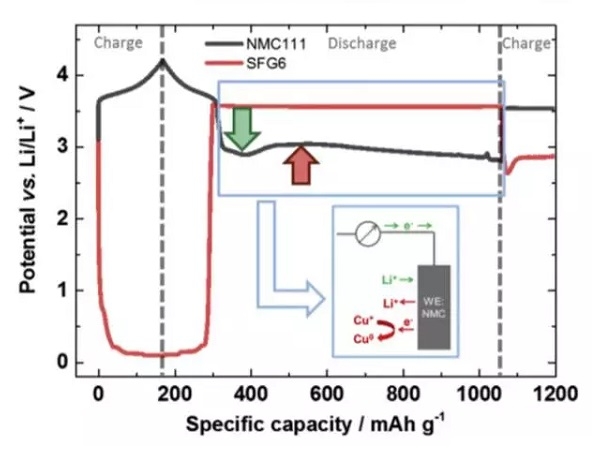
在整個過放電的過程中,正負極電勢變化如下圖所示,可以看到負極電勢維持在3.56V左右,對應的為銅箔的溶解。而正極電勢變化的趨勢則比較有特別,隨著銅箔的溶解,正極電勢達到了一個最低點,隨後有一些輕微的反彈,然後正極的電勢開始緩慢向著2.8V截止電壓下降,嵌鋰造成NMC電勢下降用綠色箭頭進行了標識,銅在NMC表面沉積造成的電壓下降用紅色箭頭進行了標識,Li+嵌入反應和銅的沉積同時在正極表面發生。
隨著放電狀態轉變為充電狀態,正負極的電勢發生了反轉,即正極電勢高於負極。但是我們看到充電時正極的電勢相當於充放電狀態反轉之前負極的電勢,這表明此時正極發生的反應為其表面沉積的銅再次溶解,這也驗證了負極銅箔在過放電過程中發生了溶解,並在正極表面發生了沉積。
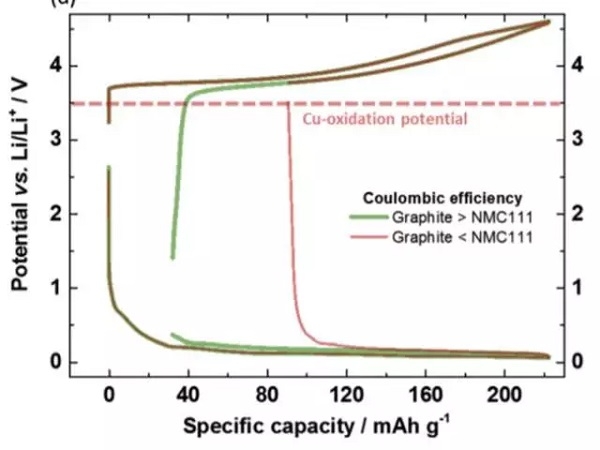
为了避免铜箔在放电的过程中发生氧化和溶解,就需要控制负极的电势不高于3.56V vs Li+/Li。在实际的过程中,负极的电势受到电池电压的控制,下图展示了当负极的首次效率高于正极,首次效率低于正极时,在充放电过程中的电势的变化。当负极的首次效率高于正极时,由于正极损失的容量较多,因此在放电时虽然正极已经完全嵌锂,但是负极仍然保有部分锂,因此负极的电势较低,也就不会发生铜箔溶解的问题。但是当负极的首次效率较低时,放电的过程中正极还没有完全嵌锂,此时负极的锂已经消耗完毕,特别是放电截止电压又比较低时,就有可能会导致负极的电势过高,导致铜箔的溶解。因此为了避免铜箔的溶解就需要对锂离子电池的放电截止电压进行谨慎的选择,避免负极的电势过高。
在電池的循環過程中,隨著負極SEI膜的不斷生長,消耗有限的Li+,可能會加劇負極Li+不足,導致其在放電的過程中電勢過高,引起銅的溶解,因此需要對壽命末期的鋰離子電池的截止電壓進行格外的關注,一般來說將放電截止電壓設的高一點有利於降低銅箔溶解的風險,因此Johannes Kasnatscheew認為將截止電壓設為3V可以將銅箔溶解的風險降到最低,提高鋰離子電池的循環壽命。



